临床研究(研究者发起研究)伦理审查申请
研究方案送审流程(科研)
1、第一步:确认申请的类别
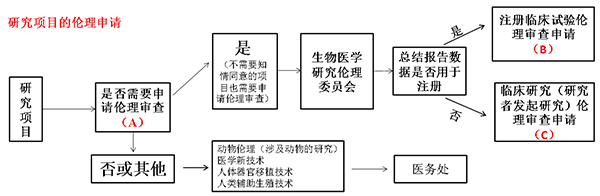
A:符合以下条件的研究均需申请伦理审查
(一)采用现代物理学、化学、生物学、中医药学和心理学等方法对人的生理、心理行为、病理现象、疾病病因和发病机制,以及疾病的预防、诊断、治疗和康复进行研究的活动;
(二)医疗新产品(药物、医疗器械、体外诊断试剂等)在人体上进行试验研究的活动;
(三)采用流行病学、社会学、心理学等方法收集、记录、使用、报告等进行的活动;
(四)储存有关人的样本、以及利用储存的样本进行的活动;
(五)利用医疗记录、行为等科学研究资料的活动。
B:注册临床试验是由申办者(一般是制药企业)负责发起、申请、组织、监查和稽查,并提供试验经费。申办者按国家法律、法规等有关规定,向国家药品监督管理局(NMPA)递交注册申请的项目。
C:临床研究(研究者发起研究)是研究者发起研究,包括国家各级政府成立基金(科技部、国自然等)支撑的科研项目(课题)、来自于企事业单位的横向科研合作开发项目(课题)及科室自筹科研项目(课题)等。
2、第二步:初始审查的递交(首次递交申请)
注:可至内网科研处“办事指南”处观看“科研项目登记及伦理申请操作”视频。
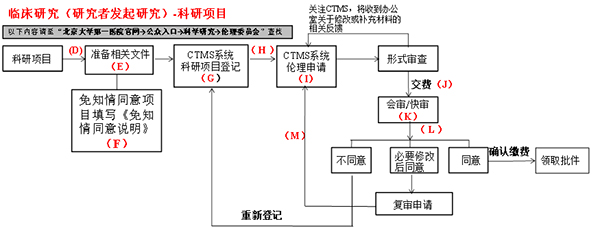
D:首次申请推荐阅读“伦理审查申请常见问题与解答” (“通知与公告”项下)
E:按照“临床研究(研究者发起研究)伦理审查申请”项下,送审文件清单(科研)中“一、科研项目研究方案初次申请审查时,应提交的文件”准备相关文件。部分表格需在线填写后,打印、签字上传。
F:免除签署知情同意书情形:1.利用可识别身份信息的人体材料或者数据进行研究,已无法找到该受试者,且研究项目不涉及个人隐私和商业利益的;2.生物样本捐献者已经签署了知情同意书,同意所捐献样本及相关信息可用于所有医学研究的。如项目为回顾性研究,或研究者认为项目无需知情同意,可填写《免知情同意说明》。经伦理委员审查后如不同意免除知情同意,则仍需再次提交知情同意书。
G:按照“通知与公告”项下临床试验项目管理系统(CTMS )操作说明中“二、临床研究伦理审查申请”CTMS 操作手册科研项目登记.pdf文件进行立项。本院职工(在编和派遣制职工)账号:5位工号,密码:5位工号。如果没有账号请致电66119025-803获取(研究生和进修生无账号且不能申请)。
H:科研项目登记时只需填写带“*” 号的试验基本信息和相关人员,无需上传材料。科研项目登记成功后,无需等待办公室审批,可直接进行伦理申请。
I:按照“通知与公告”项下临床试验项目管理系统( CTMS)操作说明中“二、临床研究伦理审查申请” CTMS操作手册伦理申请(研究者篇) .pdf文件填写申请并上传相关文件。
J:按照“临床研究(研究者发起研究)伦理审查申请”项下,根据“收费标准”中的费用,按照“交款方式及交款指南(科研)”中的要求和流程缴费。
K:会审:主要研究者或者其指派的代表(应熟知所有递交伦理审查的文件)请按照伦理秘书通知的时间和地点,回答伦理委员会成员的提问。会议进入决定程序时,研究者应离场。对主要研究者或者其指派的代表不能参加会议审查时,该项目将推迟到下一次会议审查;快审:①多中心研究我院作为参加单位;②北京大学生物医学伦理委员会已通过审查的项目的初次申请审查;③免知情同意项目
L:登录CTMS
M:根据“意见通知函”要求修改相关文件,按照“临床研究(研究者发起研究)伦理审查申请”项下,“送审文件清单(科研)” 中“二、伦理委员会审查意见为‘必要修改后同意’修改后申请时,需提交的文件”,按照CTMS 操作手册伦理申请(研究者篇).pdf中“伦理审查复审申请(初审后复审、修正案审查后复审)”操作。复审一般情况下审查形式为快审。
3、第三步:跟踪审查的递交(获取批件,试验启动后)
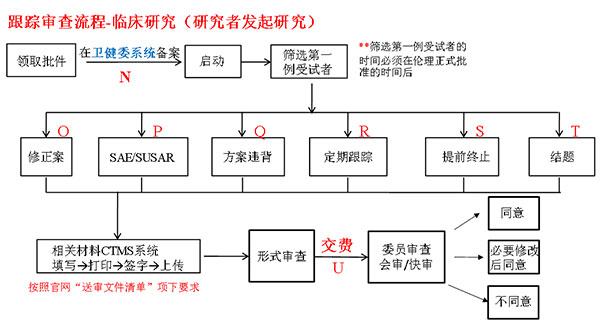
N:网址:61.49.19.26/login,具体可至“通知与公告”项下“伦理审查申请常见问题与解答”中“四、国家全民健康保障信息平台(医学研究登记备案信息系统)”项下查看。
O:经批准的文件有任何的修改都应在实施前报告给伦理委员会(紧急情况除外)包括研究方案、知情同意书、研究手册、招募广告、原始病历、病例报告表、受试者日志卡等。
P:研究过程中出现的安全性事件如SAE、SUSAR及阶段性报告(DSUR)需及时报告。按官网“通知与公告”项下“安全性信息递交伦理委员会时限要求”递交。
Q:在研究过程中出现的与批准的研究方案不符,或研究者不能遵循要求履行保护受试者的职责或偏离相关原则。
R:依照伦理批件中定期跟踪审查间隔时间的要求(在有效期前1个月申请递交),研究者应及时提交定期跟踪审查相关材料。如获取批件后未及时启动试验,也需在批件中定期跟踪审查间隔时间规定时间内申请定期跟踪审查,否则批件将作废!!。

S:在研究方案没有按照计划完成前,终止该研究。
T:研究结束后,申办方应向伦理委员会提交完整的书面报告(提交报告摘要即可)
U:按照“收费标准”交费
4、其他注意事项
(1)涉及人类遗传
①涉及到人类遗传资源采集、保藏、利用、对外提供我国人类遗传资源的项目需要按照《中华人民共和国人类遗传资源管理条例》规定在中华人民共和国科技部人类遗传办公室办理相关手续。具体步骤可至北京大学第一医院药物临床试验机构(公众版)、北京大学第一医院科研处(员工版)网页查询。
②人类遗传资源包括人类遗传资源材料和人类遗传资源信息。
人类遗传资源材料是指含有人体基因组、基因等遗传物质的器官、组织、细胞等遗传材料。
人类遗传资源信息是指利用人类遗传资源材料产生的数据等信息资料。
(2)研究方案:推荐使用“送审文件清单(科研)”中word模板《研究方案模板-科研》撰写。
请参考《科研研究方案撰写要素》完善、完整研究方案内容。可参考word版模板《研究方案模板-科研》进行撰写,模板中与本研究无关内容可写“不适用”。
(3)知情同意书:推荐使用“送审文件清单(科研)”中下载模板以保证内容要点的全面。
①关于免知情(该文件必须使用“送审文件清单(科研)”中下载模板):以下情形经伦理委员会审查批准后,可以免除签署知情同意书:a.利用可识别身份信息的人体材料或者数据进行研究,已无法找到该受试者,且研究项目不涉及个人隐私和商业利益的;b.生物样本捐献者已经签署了知情同意书,同意所捐献样本及相关信息可用于所有医学研究的。如项目为回顾性研究,或研究者认为项目无需知情同意,可填写《免知情同意说明》,经伦理委员审查后如不同意免除知情同意,则仍需再次提交知情同意书;
②干预类研究请下载《知情同意书模板(干预类项目)》;
③数据标本采集类研究请下载《知情同意书模板(数据标本采集类项目)》;
④生物样本库类研究请使用《知情同意书模板(生物样本库类)》;
⑤如研究同时涉及“前瞻”和可免知情的“回顾”,可同时分别提供前瞻性研究部分知情同意书和回顾性研究部分《免知情同意说明》;
⑥如研究人群涉及未成年人,一般来说,应分别设计未成年版本(如8-11岁儿童版本、12-17岁青少年版本)和监护人版,同时称呼应对应相应人群,如“您”、“您的孩子”等。其中未成年人版的语言应符合该年龄段特点。例如研究项目的入选人群年龄范围为0-60岁,则应有8-11岁儿童版本、12-17岁青少年版本、成年人版、监护人版三份知情同意书。(对于一些特殊疾病,如智力认知发育有障碍,能否参与或签署知情同意取决于能力而不仅是年龄)
⑦如研究涉及不同处理措施,例如对照组和试验组,则应分别设计“对照组知情同意书”和“试验组知情同意书”两个版本;
⑧模板中的蓝色字体提交前应删除,同时请将模板中与本研究无关内容删除或进行修改。
⑨内容应与研究方案及其他文件一致。
(4)主要研究者简历(该文件必须使用“送审文件清单(科研)”中下载模板)
(5)主要研究者声明(该文件必须使用“送审文件清单(科研)”中下载模板)
(6)必须提交文件为“送审文件清单(科研)”中灰色部分文件,招募广告、病例报告表等可视实际情况提交或审查后按修改意见提交。







 北京市西城区西什库大街8号
北京市西城区西什库大街8号 100034
100034 83572211
83572211